
Výukové materiály ZŠ Kaplice, Školní 226

k anorganické chemii |
podle kyselosti |
příklady |
|---|
Definice1
Hydroxidy jsou tříprvkové sloučeniny, které obsahují hydroxidové anionty OH- vázáné na kationty kovů (popřípadě na amonný kation NH4+).
Příklady
KOH - hydroxid draselný
obr. wikipedie
NH4OH - hydroxid amonný
obr. Animovaná chemie - CD obr. Animovaná chemie - CD
Názvosloví
a. vzorec --->název
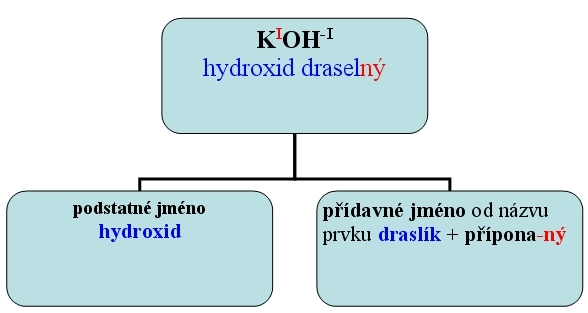
Hydroxidy ox. č. přípona název vzorec - ný hydroxid draselný KIOH - natý hydroxid vápenatý CaII(OH)2 - itý hydroxid železitý FeIII(OH)3 - ičitý hydroxid manganičitý MnIV(OH)4
Nejvyšší oxidační číslo atomu (kationtu) kovu v hydroxidech je IV.
b. název--->vzorec
hydroxid vápenatý
Ca OH
CaII OH-I
1 2
Ca(OH)2
Definice2
Hydroxidy jsou látky, které ve vodě uvolňují hydroxidové anionty OH-
KOH ---> K+ + OH-
hydroxidový anion
Společné vlastnosti hydroxidů
1. Barví lakmus modře a fenolftalein červeno-fialové.
2. Mají hodnoty pH větší než 7.
3. Roztoky koncentrovaných hydroxidů jsou žíraviny.
obr. wikipedie
Hydroxidy patří k látkám, které leptají sliznice a poškozují pokožku! Proto při práci s hydroxidy používat gumové rukavice, ochranný štít, popř. brýle.
První pomoc
a. oplach proudem pitné vody
b. při požití výplach úst a po malých doušcích pít vodu
c. lékařské vyšetření
4. Ve vodě uvolňují hydroxidové anionty, probíhá ionizace.
hydroxid ---> hydroxidový anion + kation hydroxidu
NaOH ---> OH- + Na+
5. Vedou elektrický proud
6. Reagují s kyselinami (neutralizační reakce) - vzniká sůl a voda:
NaOH + HCl ---> NaCl + H2O
Významné hydroxidy
1. Hydroxid draselný KOH, hydroxid sodný NaOH
Výroba
elektrolýza roztoku NaCl (KCl)
elektrolýza
2NaCl + 2H2O ---> 2 NaOH + Cl2 + H2
Vlastnosti
- bílé pevné látky, dobře rozpustné ve vodě (při rozpuštění se uvolňuje teplo)
- koncentrované roztoky jsou žíraviny (nazývané též louhy)
- pohlcují vzdušnou vlhkost a reagují s CO2 (musí se uchovávat v dobře těsnící nádobě)
2NaOH + CO2 ---> Na2CO3 + H2O
- reagují s kyselinami (jde o reakci neutralizace) přičemž vzniká sůl a voda:
KOH + HCl ---> KCl + H2O
Použití
- při výrobě papíru, mýdel, hliníku, plastů, odstraňování starých nátěrů
- základní suroviny v chemickém průmyslu
2. Hydroxid vápenatý - Ca(OH)2 (hašené vápno)
Výroba
1.Tepelný rozklad vápence CaCO3
CaCO3 ---> CaO + CO2
2. Reakce páleného vápna CaO s vodou
CaO + H2O ---> Ca(OH)2
Vlastnosti
- pevná, bílá látka, méně rozpustný než KOH, nejlevnější
- reaguje s CO2 - tvrdnutí malty
Ca(OH)2 + CO2 ---> CaCO3 + H2O
- reaguje s kyselinami - neutralizace
Ca(OH)2 + 2HCl ---> CaCl2 + 2H2O
Použití
- zemědělství (hnojivo pro kyselé půdy), při výrobě cukru a sody
- stavebnictví - hašené vápno, vápenná malta - bílení zdi, omítaní zdí dezinfekční účinky
3. NH4OH - hydroxid amonný
Výroba
- slučování dusíku a vodíku: N2 + 3H2 ---> 2NH3
NH3 + H2O ---> NH4OH
Vznik
- rozkladem živočišných i rostlinných zbytků a způsobuje zápach, např. ve chlévech a na záchodech
Vlastnosti
- NH3 a jeho roztok patři mezi žíraviny
- štiplavě zapáchá, dráždí dýchací cesty a je jedovatý
- ve vodném roztoku se rozkládá na ionty:
NH4OH ---> NH4+ + OH-
- reaguje s kyselinami:
NH4OH + HNO3 ---> NH4NO3 + H2O
Použití
- výroba HNO3, dusíkatých hnojiv, barev, sody