
Výukové materiály ZŠ Kaplice, Školní 226

k anorganické chemii |
podle kyselosti |
příklady |
|---|
Definice1
Kyseliny jsou látky, které ve vodě uvolňují kationy vodíku H+.
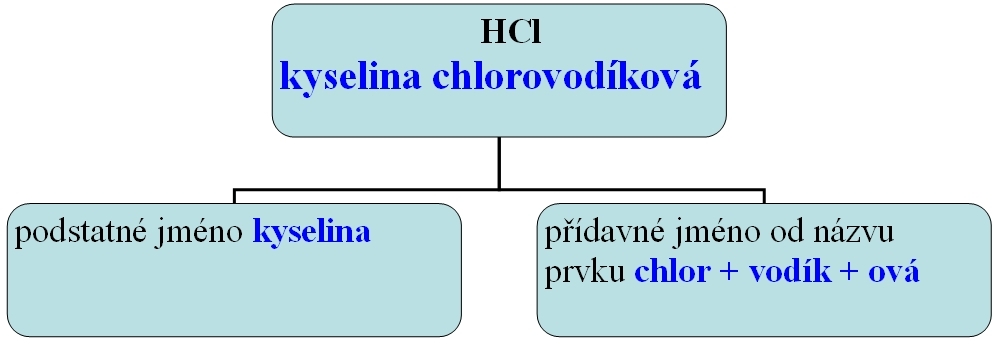
Př. kyselina chlorovodíková HCl
HCl ---> H+ + Cl-
Společné vlastnosti kyselin
1. Mají kyselou chuť.
2. Barví lakmus červeně.
3. Mají hodnoty pH menší než 7.
4. Koncentrované kyseliny jsou žíraviny - naleptávají pokožku, textil, kovy, přírodu.
obr. wikipedie
(Kyseliny patří k látkám, které leptají sliznice a poškozují pokožku! Proto při práci s kyselinami používat gumové rukavice, ochranný štít, popř. brýle).
Ředění kyselin: - kyselinu liji do vody. NIKDY NE NAOPAK!!!
První pomoc při polití kyselinou:
- postižené místo alespoň 20 minut vymývat proudem studené vody
- při požití necháme postiženého vypít mléko s vajíčkem nebo s živočišným uhlím
- vždy doprava k lékaři
5. Kyseliny reagují s reaktivními kovy za vzniku vodíku a soli.
2HCl + Mg ---> H2 +MgCl2
POŘADÍ CHEMICKÉ AKTIVITY
Li K Ba Ca Na Mg Al Be Mn Zn Cr Fe Cd Co Ni Sn Pb H2 Sb Cu Hg Ag Pt Au
6. Kyseliny vedou elektrický proud (jejich roztoky obsahují volně pohyblivé ionty).
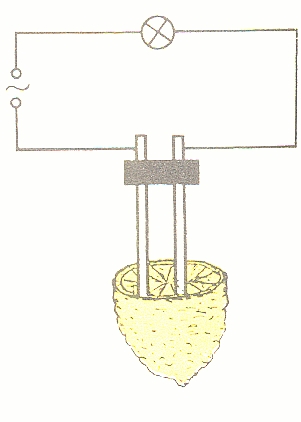
obr. Animovaná chemie - CD
7. Obsahují odštěpitelné vodíky (ve vodném roztoku ionizují - probíhá ionizace)
kyselina ---> H+ (vodíkový kation) + anion kyseliny
H+ + H2O ---> H3O+(oxoniový kation)
H+ je nositelem kyselosti - převažuje-li v roztoku, roztok je kyselý.
obr. Chemie 1
Příklady:
HCl ---> H+ + Cl-
Definice2
Kyseliny jsou dvou nebo víceprvkové sloučeniny obsahující vodík, kyselinotvorný prvek (halogeny, C, S, P, N) popřípadě i kyslík.
Třídění kyselin podle složení
1. bezkyslíkaté (H+ + nekovový prvek):
Př. kyselina chlorovodíková - HCl
Názvosloví
HF - kyselina fluorovodíková
HI - kyselina jodovodíková
HBr - kyselina bromovodíková
H2S - kyselina sirovodíková
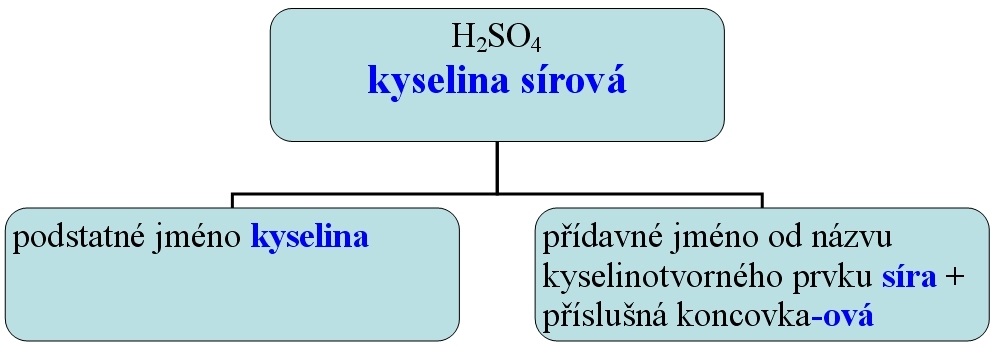
2. kyslíkaté (H+ + kyselinotvorný prvek (centrální atom) + kyslík): kyselina sírová - H2SO4, kyselina uhličitá - H2CO3
Názvosloví
a. vzorec ---> název
Kyslíkaté kyseliny ox. č. přípona název vzorec I - ná kyselina bromná HBrIO II - atá kyselina olovnatá H2PbIIO2 III - itá kyselina boritá HBIIIO2 IV - ičitá kyselina uhličitá H2CIVO3 V - ičná kyselina dusičná HNVO3 - ečná kyselina chlorečná HClVO3 VI - ová kyselina sírová H2SVIO4 VII - istá kyselina jodistá HIVIIO4 VIII - ičelá kyselina osmičelá H2OsVIIIO5
b. název ---> vzorec
kyselina chlorná
- napíšeme značky prvků a jejich oxidační čísla HIClIOx-II,
- zjistíme počet atomů vodíku tak, že když je centrální atom v lichém oxidačním čísle, stačí přibrat jeden vodík. Když je to sudé oxidační číslo, musí se vzít dva vodíky.
- určíme počet atomů kyslíku: 1.(I) + 1.(I) + x.(-II)=0
x = 1
HClO
kyselina uhličitá
HICIVO-II
po zjištění počtu atomů vodíku (teď 2) vypočteme počet atomů kyslíku
2.(I) + 1.(IV) + x.(-II)=0
x=3
H2CIVO3
Významné kyseliny
1. Kyselina chlorovodíková HCl (kyselina solná)
Výroba
a) syntéza
vodík + chlor ---> chlorovodík
H2 + Cl2 ---> 2HCl
b) kyselina sírová + chlorid sodný ---> plyn HCl + síran sodný
H2SO4 + 2NaCl ---> 2HCl + Na2SO4
HCl + H2O ---> H3O+ + Cl-
Vlastnosti
a) fyzikální
- bezbarvá, těkavá kapalina, pro technické účely nažloutlá
- dráždí dýchací cesty a leptá pokožku - koncentrovaná HCl je silná žíravina!

- 0,3% - 0,4% - součást žaludečních šťáv pomáhá při trávení potravy
b) chemické
- při rozpuštění ve vodě ionizuje: HCl ---> H+ + Cl-
- reaguje s reaktivními kovy
kyselina chlorovodíková + sodík ---> vodík + chlorid sodný
2HCl + 2Na ---> H2 + 2NaCl
Použití - výroba barviv, léčiv, plastů PVC, čištění kovů, k výrobě chloridů
2. Kyselina sírová H2SO4 (krev průmyslu)
Výroba - probíhají tři základní reakce
síra + kyslík ---> oxid siřičitý
S + O2 ---> SO2
oxid siřičitý + kyslík ---> oxid sírový
2SO2+ O2 ---> 2SO3
oxid sírový + voda ---> kyselina sírová
SO3+ H2O ---> H2SO4
Vlastnosti
a) fyzikální
- bezbarvá těžká olejovitá kapalina, hygroskopická (odebírá vodu z organických látek vodík a kyslík)
- koncentrovaná H2SO4 je silná žíravina! Při jejím ředění přiléváme kyselinu do vody!
b) chemické
- při rozpuštění ve vodě ionizuje: H2SO4 ---> 2H+ + SO42-
síranový anion
- reaguje s reaktivními kovy a vznikají sírany (soli) a vodík
kyselina sírová + draslík ---> vodík + síran draselný
H2SO4 + 2K ---> H2 + K2SO4
- reaguje s oxidy kovů a vznikají sírany a voda
kyselina sírová + oxid zinečnatý ---> síran draselný+ voda
H2SO4 + ZnO ---> ZnSO4 + H2O
Použití
- výroba chemikálií, syntetických vláken, průmyslových hnojiv, plastů, barviv, léčiv, a výbušnin
- čištění ropných produktů
- úprava rud
- sušení a odvodňování látek v laboratoři
- elektrolyt akumulátorů pro motorová vozidla
3. Kyselina dusičná HNO3
Vlastnosti
a) fyzikální
- bezbarvá až nažloutlá těkavá kapalina, na světle se částečně rozkládá, uvolňují se jedovaté oxidy - tmavé láhve
-dráždí dýchací cesty, leptá -koncentrovaná HNO3 je silná žíravina!

b) chemické
-ionizace HNO3 ---> H+ + NO3-
dusičnanový anion
- reaguje se všemi kovy, až na Au a Pt a vznikají soli - dusičnany (obsahují dusičnanový anion NO3-)
2HNO3 + Na ---> NaNO3 + H2O + NO2
Použití - výroba léčiv, výbušnin (dynamit) a dusíkatých průmyslových hnojiv (ledek)
Lučavka královská - směs kyseliny dusičné a chlorovodíkové v objemovém poměru 1:3 - reaguje se zlatem a platinou
Další významné kyseliny:
- Kyselina fosforečná (trihydrogenfosforečná) H3PO4
- Kyselina uhličitá H2CO3
- Kyselina siřičitá H2SO3