
Výukové materiály ZŠ Kaplice, Školní 226

prvky |
soustava |
vazba |
látek |
příklady |
|---|
Řecký filozof Demokritos, (460 - 370 př.n.l.): - "hmota se skládá z velmi malých částeček, které jsou dál nedělitelné, z atomů (atomos = nedělitelný)"
19. století anglický chemik John Dalton (1766 - 1844)každá hmota se skládá z atomů, částeček již nedělitelných atomů je tolik druhů, kolik je prvků
Angličan Joseph John Thomson 1897 : atomy všech prvků obsahují částice o hmotnosti 9,1 . 10-31 kg – elektrony
obr. Animovaná chemie - CD
Angličan Ernest Rutherford (1871 - 1937): - "kladný náboj atomu nese jádro atomu a je v něm soustředěná převážná většina hmoty atomu; kolem něho obíhají elektrony"
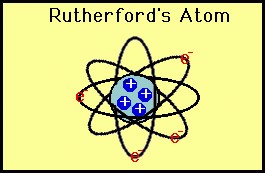
obr. Animovaná chemie - CD
Dánský fyzik Niels Bohr (1885 - 1962) upravil tuto teorii tak, že se elektrony pohybují kolem jádra po uzavřených drahách o určitém poloměru bez vyzařování elektomagnetického záření. Energie elektronu se může měnit pouze nespojitě, ve skocích, v kvantech energie.
(Počátek 20. stol. rozmach kvantové mechaniky – Einstein, Pauli, Schrödinger, Fermi, Heisenberg)
ELEKTRON má duální charakter – projevuje se jako částice (korpuskule) i jako vlnění.
Atom
Látky jsou složeny z atomů, molekul nebo iontů.
Stavba atomu
Jádro protony - p+ - kladný náboj
neutrony - no - neutrální
Elektronový obal - e- - záporný náboj
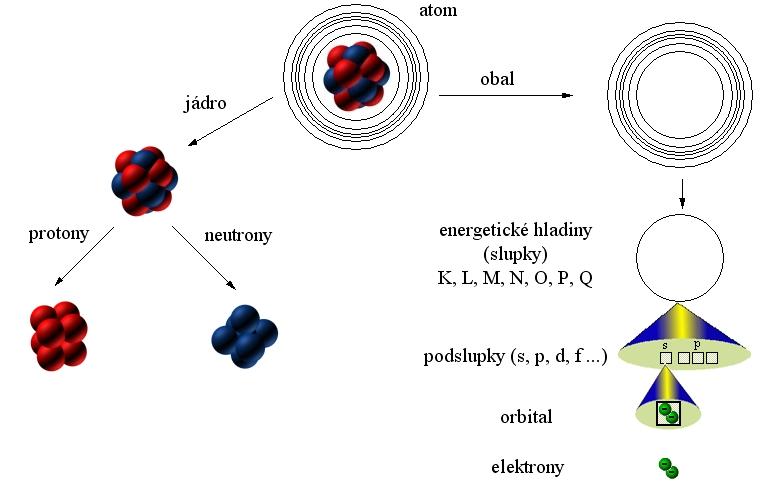
obr. Animovaná chemie - CD
Atomové jádro
Z - protonové číslo - udává počet protonů v jádru
N - neutronové číslo - udává počet neutronů v jádru
A - nukleonové číslo - udává počet protonů a neutronů v jádru
A = Z + N
Jádro označujeme: AZX
Většina hmoty atomu je soustředěna v jádře mp > me mp ~2000 me
Velikost jádra - makové zrnko; obal atomu jako je pětipatrová budova.
Elektronové vrstvy (hladiny, slupky)
Elektrony jsou v obalu uspořádány do vrstev - elektronové vrstvy (v každé je omezený počet elektronů).
(1) (K) - 2e (2) (L) - 8e (3) (M) - 18e ...... (7) (Q)
Nepatrné elektrony se pohybují v prostoru.
Počet protonů v jádře = počtu elektronů v obalu. Atom je elektricky neutrální.
Model atomu uhlíku
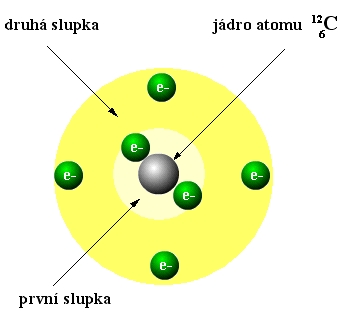
obr. Animovaná chemie - CD
Zápis C (2 4) - elektronová konfigurace
Vnější vrstva elektronů se nazývá valenční.
Elektrony vnějších, nezaplněných vrstev mají název "valenční". Valenční elektrony ovlivňují chemické vlastnosti prvků - mají největší energii.
Valenční elektrony jednoho atomu mohou tvořit chemické vazby s valenčními elektrony jiného atomu, což vede k vytvoření nové sloučeniny (pokud se jedná o atomy různých prvků).
Valenčnost atomu ukazuje na to, kolik chemických vazeb může vytvořit tento atom s jinými atomy.
Atomy téhož prvku jsou stejné a mají tytéž vlastnosti.