




INVESTICE DO ROZVOJE VZDĚLÁVÁNÍ
Výukové materiály ZŠ Kaplice, Školní 226





- Třídění látek podle původu
- Co je organická chemie?
- Vlastnosti atomu uhlíku
- Chemická vazba v organických sloučeninách
- Chemické vzorce
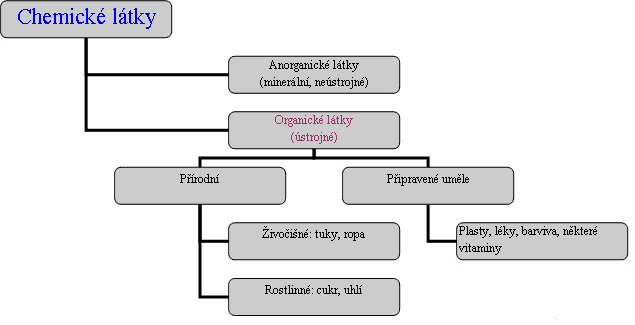
Třídění látek podle původu
Z historie:
Ještě na začátku 19. století se předpokládalo, že organické látky mohou vznikat jen v živých organismech, a to působením jakési životní síly, "vis vitalis", proto se tato teorie nazývala "vitalistická".
V roce 1828 se podařilo německému chemikovi Friedrichu Wohlerovi připravit v laboratoři organickou látku močovinu z anorganické sloučeniny - kyanatu amonného NH4CNO. Tímto pokusem byla vyvrácena vitalistická teorie a otevřela se cesta k syntézám mnoha dalších organických látek.
Srovnání vlastností anorganických a organických látek
vlastnosti látek chlorid sodný naftalen rozpustnost ve vodě rozpustný nerozpustný barva bílá bílá zápach bez zápachu zapáchá tavitelnost 800°C 80°C hořlavost nehoří hoří
Závěr: Organické látky jsou většinou nerozpustné ve vodě, lehce tavitelné a hořlavé.
nahoru
Co je organická chemie?
Organická chemie je věda zabývající se studiem struktury, reaktivity, vlastností, přípravou a použitím organických sloučenin.
Organické sloučeniny jsou sloučeniny uhlíku s výjimkou několika jednoduchých anorganických látek (oxidy uhlíku, kyselina uhličitá, její soli apod.)
Organické sloučeniny vznikají hlavně při látkových přeměnách v organismech a jsou základní stavební složkou jejich těl.
Složení organických látek: uhlík, vodík, kyslík, dusík, fosfor, síra, halogeny (F, Cl, Br, I) a jiné prvky.
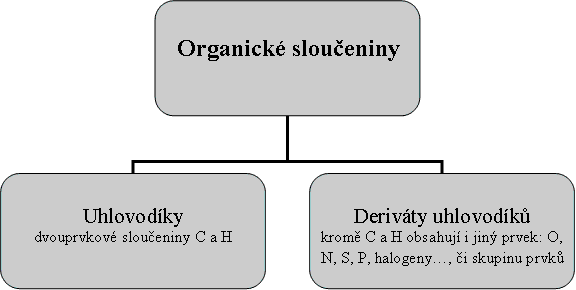
Organické sloučeniny získáváme:z přírodních zdrojů (dřevo, ropa, uhlí, zemní plyn) syntézou
nahoru
Vlastnosti atomu uhlíku
1. Atomy uhlíku vytvářejí v molekulách organických sloučenin čtyři vazby, říkáme, že jsou čtyřvazné.
(Elektronová konfigurace uhlíku: Z = 6 C (2 4) 4 valenční elektrony)
2. Vazby mezi atomy uhlíku mohou být:
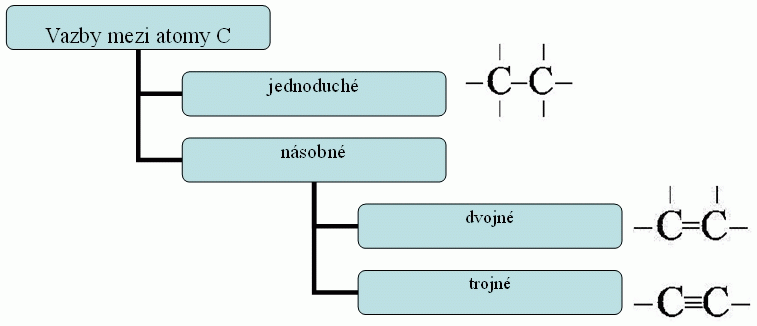
3. Atomy uhlíku jsou schopny vzájemně se spojovat kovalentními vazbami a vytvářet uhlíkaté řetězce různých tvarů a délek:
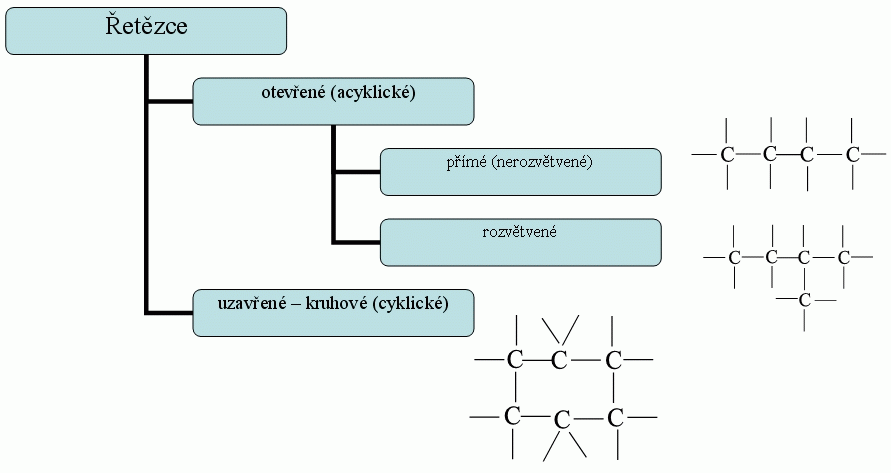
nahoru
Chemická vazba v organických sloučeninách
Chemická vazba v organických sloučeninách je kovalentní. Vzniká sdílením elektronů mezi atomy, přičemž vzniká elektronový pár.
Kovalentní vazbu zapisujeme čárkou mezi značkami vázaných atomů. (Kovalentní vazba se vyskytuje, vedle dalších druhů vazeb, i mezi atomy látek anorganických).
Podle počtu elektronových párů mluvíme o kovalentní vazbě:
1. Jednoduché
obr. Animovaná chemie - CD
2. Dvojné
obr. Animovaná chemie - CD
3. Trojné
obr. Animovaná chemie - CD
Uhlík Z = 6 C (2 4) 4 valenční elektrony, atomy uhlíku jsou čtyřvazné.
Vodík Z = 1, atom vodíku je jednovazný.
Halogeny Z = 9 F (2 7), atomy halogenů jsou jednovazné.
Kyslík Z = 8 O (2 6), atomy kyslíku jsou dvojvazné.
Dusík Z = 7 N (2 5), atomy dusíku jsou trojvazné.
nahoru
Vzorce v organické chemii
1. Molekulové vzorce (vzorce souhrnné, sumární) - vyjadřují počet a druh atomů v molekule.
Př. CO2, CH4, C2H6, C3H8
2. Strukturní vzorce - znázorňují vazby mezi atomy a uspořádání atomů.
Př. O=C=O
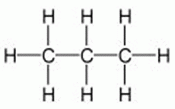
3. Racionální vzorce - vyjadřují druh a počet chrakteristických skupin atomů (zjednodušený zápis strukturního vzorce).
Př. CH3CH3 ethan
CH3CH2CH3 propan