
Výukové materiály ZŠ Kaplice, Školní 226

k anorganické chemii |
podle kyselosti |
příklady |
|---|
nahoruSulfidy
Příprava
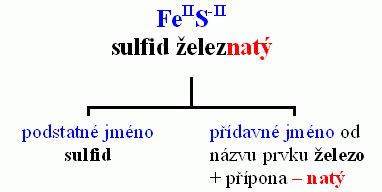
Fe + S ---> FeS
sulfid železnatý
Definice
Sulfidy jsou dvouprvkové sloučeniny síry s kovem nebo polokovem, ve kterých atomy síry mají oxidační číslo - II.
Názvosloví
Název sulfidů je dvouslovný. Podstatné jméno je tvořeno slovem sulfid. Přídavné jméno je tvořeno názvem prvku, který se váže se sírou, s příponou příslušného oxidačního čísla.
Sulfidy ox. č. přípona příklady název vzorec I - ný sulfid draselný K2IS-II II - natý sulfid vápenatý CaIIS-II III - itý sulfid železitý Fe2IIIS3-II VII - istý sulfid manganistý Mn2VIIS7-II VIII - ičelý sulfid rutheničelý RuVIIIS4-II
Významné sulfidy
1. Galenit - sulfid olovnatý - PbS
Vlastnosti - krystalická, stříbřitá šedá látka, s velkou hustotou
Použití: - surovina pro výrobu olova
2. Sfalerit - sulfid zinečnatý - ZnS
Vlastnosti - krystalická, hnědá, černá nebo žlutá látka
Použití: - surovina pro výrobu zinku
3. Sulfid sodný Na2S
- vyrábí se redukcí síranu sodného uhlíkem
- používá se v koželužství, při zpracování celulózy atd.
4. Pyrit - disulfid železnatý - FeS2
- výroba železa
Halogenidy
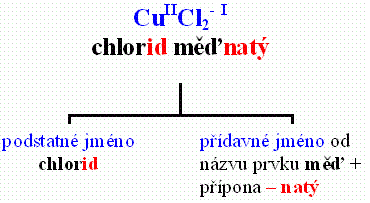
Příprava
Cu + Cl2 ---> CuCl2
chlorid měďnatý
Definice
Halogenidy jsou dvouprvkové sloučeniny halogenů (fluor, chlor, brom, jod) s jiným prvkem. Atomy halogenů zde mají oxidační číslo -I.
Názvosloví
Název halogenidů je dvouslovný. Podstatné jméno je tvořeno názvem halogenu, k němuž se přidává přípona -id. Přídavné jméno je tvořeno názvem druhého prvku s příponou podle příslušného oxidačního čísla.
Halogenidy ox. č. přípona příklady název vzorec I - ný jodid draselný KII-I II - natý fluorid vápenatý CaIIF2-I III - itý chlorid železitý FeIIICl3-I IV - ičitý chlorid uhličitý CIVCl4-I V - ečný bromid fosforečný P VBr5-I - ičný fluorid arseničný AsVF5-I VI - ový fluorid sírový SVIF6-I VII - istý fluorid jodistý IVIIF7-I VIII - ičelý fluorid osmičelý OsVIIIF8-I
Významné halogenidy
1. Chlorid sodný NaCl (kuchyňská sůl)
Výskyt - jako nerost sůl kamenná (halit), ve velkém množství v mořích a oceánech
Vlastnosti - krystalická, bezbarvá látka, dobře rozpustná ve vodě
Použití
- surovina pro výrobu chloru, hydroxidu sodného, mýdel
- nezbytná složka potravy živočichů
- konzervace potravin
2. Bromid stříbrný - AgBr
Vlastnosti -látka citlivá na světlo, nerozpustná ve vodě.
Výroba
AgNO3 + NaBr ---> AgBr + NaNO3
Reakci, při níž z výchozích látek v roztoku vzniká málo rozpustný produkt (sraženina), nazýváme srážecí reakce.
Použití - v černobílé fotografii a při RTG snímkování
3. Chlorid draselný - KCl
- nachází se v mořské vodě, používá se jako draselné hnojivo, ve farmacii, při výrobě mýdel atd.
4. Fluorid vápenatý - CaF2
- minerál kazivec (fluorit)
- používá se při výrobě HF a v hutnictví