
Výukové materiály ZŠ Kaplice, Školní 226

k anorganické chemii |
podle kyselosti |
příklady |
|---|
Příprava
a) 4Fe + 3O2 ---> 2Fe2O3
oxid železitý
kov + kyslík ---> oxid kovu
b) S + O2 ---> SO2
oxid siřičitý
nekov + kyslík ---> oxid nekovu
Definice
Oxidy jsou dvouprvkové sloučeniny kyslíku a dalšího prvku.
Názvosloví
Název oxidu je dvouslovný. Podstatné jméno je tvořeno slovem oxid. Přídavné jméno je tvořeno názvem prvku a příponou podle příslušného oxidačního čísla. V oxidech má kyslík vždy oxidační číslo -II. Počty vázáných atomů krátíme na nejmenší možný poměr.
Oxidační čísla atomů prvků ve sloučeninách se vyjádří v názvu příponami:
Ox. č. Přípona Příklady oxidů
Poměr počtu atomů
prvku sloučených
v oxidu
(slučovací poměr)název vzorec I - ný oxid draselný K2IO-II 2:1 II - natý oxid vápenatý CaIIO-II 1:1 III -itý oxid železitý Fe2IIIO3-II 2:3 IV - ičitý oxid křemičitý SiIVO2-II 1:2 V - ečný oxid chlorečný Cl2VO5-II 2:5 - ičný oxid dusičný N2 VO5-II VI - ový oxid sírový SVIO3-II 1:3 VII - istý oxid manganistý Mn2VIIO7-II 2:7 VIII - ičelý oxid rutheničelý RuVIIIO4-II 1:4
a) Psaní vzorců oxidů
Postup oxid sírový oxid hlinitý 1. Napíšeme si značky prvků, které jsou v oxidu vázány. SO AlO 2. Podle zakončení přídavného jména v názvu doplníme ox.č. SVI O sírový AlIIIO hlinitý 3. Doplníme oxidační číslo atomů kyslíku v oxidech. SVIO-II AlIIIO-II 4. Použijeme křížové pravidlo pro určení počtu vázáných atomů. (Upravíme počet
vázaných atomů tak, aby se součet atomů ve vzorci rovnal nule.)
Poměr vázáných atomů musí být vždy co nejmenší.
Pokud je to nutné, vydělíme počty vázaných atomů co největším stejným číslem,
aby počty atomů byla celá čísla.SVIO-II
2 : 6
1 : 3
SO3
1.(VI) + 3.(-II)=0AlIIIO-II
2 : 3
Al2O3
2.(III) + 3.(-II)=0
b) Určení názvu oxidu ze vzorce
nahoru
1. Zapíšeme ox.č. atomů kyslíku v oxidu Cl2O7-II 2. Určíme ox.č. atomu druhého prvku Cl2xO7-II
2.x+7.(-II)=0
x=VII3. K názvu druhého prvku přidáme příponu, která odpovídá oxidačnímu číslu jeho atomů,
a získáme tak přídavné jméno názvu.chloristý 4. K podstatnému jménu přidáme odvozené přídavné jméno oxid chloristy Některé významné oxidy

obr. Animovaná chemie - CD
1. Oxid siřičitý SO2
Vznik:
- hoření síry ve vzduchu (uniká při chemických výrobách, spalování nekvalitního uhlí)
S + O2 ---> SO2
Vlastnosti
a) fyzikální - jedovatý, bezbarvý, ostře zapáchající plyn
b) chemické - reaguje s vodou - příčina "kyselých dešťů"
SO2 + H2O ---> H2SO3
Použití:
- při výrobě celulózy a papíru ze dřeva, k bělení vlny, bavlny, slámy
- k dezinfekci sudů, sklepních prostor, včelích úlů
- při výrobě kyseliny sírové ( výroba plastů, hnojiv, mýdel, barviv, elektrolyt do akumulátorů)
2. Oxidy dusíku
Oxid dusnatý NO a oxid dusičitý NO2
Vznik
- hoření dusíku ve vzduchu (uniká při chemických výrobách a činnostech spalovacích motorů)
N2 + O2 ---> 2NO
N2 + 2O2 ---> 2NO2
Vlastnosti
a) fyzikální
NO jedovatý, bezbarvý plyn
NO2 jedovatý, hnědočervený plyn, leptající účinky
-způsobují rakovinu dýchacích cest
b) chemické
- reagují s vodou - příčina "kyselých dešťů"
4NO2 + O2 + 2H2O ---> 4HNO3
Použití
- při výrobě kyseliny dusičné (výroba plastů, hnojiv, výbušnin, léků, barviva)
3. Oxidy uhlíku
a. Oxid uhelnatý CO
Vznik
- hoření uhlíkatých látek ve vzduchu při nedostatku kyslíku
2C + O2 ---> 2CO
nebo reakci CO2 s C
CO2 + C ---> 2CO
- složka kouřových plynů různých topenišť, výfukových plynů automobilů, cigaretového kouře
Vlastnosti
a) fyzikální - velmi jedovatý, bezbarvý plyn
b) chemické - reaguje s kyslíkem - vzniká teplo
2CO + O2 ---> 2CO2 + energie
Použití
- palivo
b. Oxid uhličitý CO2
- přirozená součást vzduchu (0,03% objemu)
Vznik
- hoření uhlíkatých látek ve vzduchu při dostatku kyslíku
C + O2 ---> CO2
- při dýchaní organismů
glukosa + O2 ---> CO2 + H2O + energie
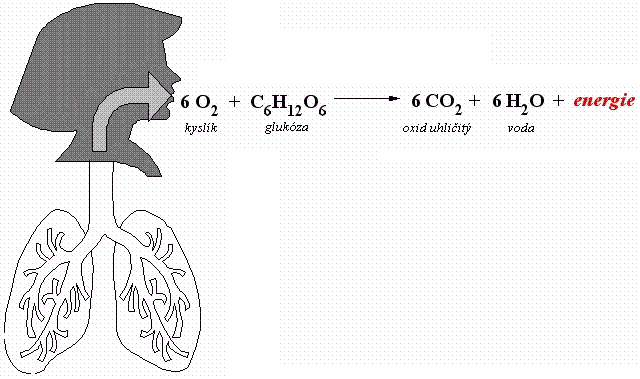
obr. Animovaná chemie - CD
Vlastnosti
a) fyzikální - bezbarvý, nedýchatelný plyn, bez chutí a bez zápachu, není jedovatý (v případě, že ve vzduchu překročí 10% - ospalost až smrt )
- větší hustota než vzduch, ve vodě částečně rozpustný - zvýšení tlaku - sifon
- způsobuje oteplování ovzduší Země - skleníkový efekt
b) chemické
- fotosyntéza ( světlo, teplo, chlorofyl) CO2 + H2O ---> glukóza + O2

obr. Animovaná chemie - CD
Použití
- k přípravě sodové vody a osvěžujících nápojů
- k přípravě sody
- k plnění hasicích přístrojů
- v chladicích zařízeních
4. Oxid vapenátý CaO ( pálené vápno)
Vznik
- tepelným rozkladem uhličitanu vápenatého:
CaCO3 ---> CaO + CO2
Vlastnosti:
a) fyzikální - bílá prášková nebo kusová látka
b) chemické - reaguje s vodou - vzniká hašené vápno
CaO + H2O ---> Ca(OH)2
Použití
- stavebnictví (výroba hašeného vápna)
- k vápnění půdy v zemědělství
- přísada pro výrobu kovů a skla
5. Oxid hlinitý Al2O3
Vznik
- hoření hliníku
4Al + 3O2 ---> 2Al2O3
-v přírodě se vyskytuje jako tvrdý nerost korund (drahokamové odrůdy: modrý safír, červený rubín)
-surovina bauxit Al2O3
Vlastnosti
a) fyzikální - bílá práškovitá látka
b) chemické - reaguje s vodou - vzniká hydroxid hlinitý
Al2O3 + 3H2O ---> 2Al(OH)3
Použití
- výroba porcelánu, hliníku
- výroba cementu a barev
- brusivo
6. Oxid křemičitý SiO2
Vznik
-v přírodě složka mnoha hornin - křemen, součást žuly, pískovců
Vlastnosti
fyzikální - pevná, těžko tavitelná a stálá látka
Použití
- stavebnictví - malta, beton
- sklářství
- hutnictví
Třídění oxidů podle elektronegativity prvku
Oxidy mohou reagovat s vodou, s kyselinami nebo hydroxidy.
1. zásadotvorné oxidy(X < 1, případně X = 1)
- reagují s vodou a vzniká hydroxid
Na2O, CaO,
Na2O + H2O ---> 2NaOH
2. kyselinotvorné oxidy (X > 2)
- reagují s vodou a vzniká kyselina
SO3, NO2, CO2
N2O5 + H2O ---> 2HNO3
3. amfoterní (obojaké) oxidy(1 < X< 2)
Amfoterní oxidy jsou většinou ve vodě nerozpustné a nereagují s ní (např. ZnO, Al2O3). Reagují však s kyselinami za vzniku vody a soli. Některé z nich reagují i s hydroxidy. Proto označení amfoterní neboli objaké.