
Výukové materiály ZŠ Kaplice, Školní 226

prvky |
soustava |
vazba |
látek |
příklady |
|---|
Atomy prvků, s výjimkou atomů vzácných plynů, nejsou schopny trvalé samostatné existence. Spojují se do složitějších celků - do molekul, krystalů popřípadě makromolekul, které jsou stabilní. Vazba mezi nimi vzniká pomocí valenčních elektronů.
Chemická vazba je spojení atomů pomoci valenčních elektronů.
Atomy, které nemají valenční vrstvu zcela zaplněnou, reagují s ostatními atomy, aby chybějící elektrony získaly. Stav, který je charakterizován úplným zaplněným valenční vrstvy, nazýváme elektronový oktet.
Oktetové pravidlo - získaní 8e- ve valenční vrstvě (nebo zaplnění valenční vrstvy):přenos valenčních elektronů sdílení valenčních elektronů
Elektronegativita je míra schopnosti daného atomu přitahovat valenční (sdílené) elektrony.
Př. X (H)=2,2; X(O)=3,5
ROZDÍL ELEKTRONEGATIVIT 0 - 0,4
vazba nepolární
atomy s velmi blízkými hodnotami elektronegativit0,4 - 1,7
vazba polární
1,7 - 3,03
vazba iontová
atomy se vzdálenými hodnotami elektronegativit
Podle způsobu vzniku vazby a hodnoty rozdílu elektronegativit rozeznáváme:A. Iontovou vazbu B. Kovalentní vazbu - polární - nepolární C. Kovovou vazbu
nahoru
A) Iontová vazba - jednotlivé atomy přijímají nebo odevzdávají elektrony za vzniku iontů. Je založena na elektrických silách působících mezi ionty.
Na - 1e ---> Na+
Cl + 1e ---> Cl-
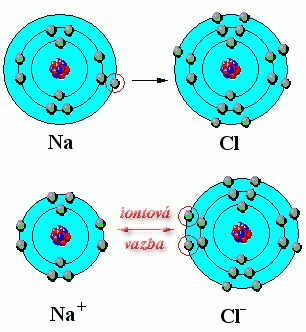
obr. Animovaná chemie - CD
X(Cl) =3 X(Na) = 0,9
Silná vazba, př. KF, CaF2
B) Kovalentní vazba - jednotlivé atomy se podělí o společné elektrony - vazba je tvořena společnou dvojicí elektronů, tzv. elektronový pár
Podle hodnoty rozdílu elektronegativit:
a)Nepolární - vzniká především mezi atomy téhož prvku
H + H ---> H-H
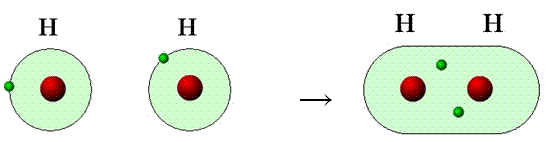
obr. Animovaná chemie - CD
b)Polární - elektronový vazebný pár je víc přitahován atomem s vyšší elektronegativitou
H + Cl ---> H - Cl X(Cl) =3 X(H)=2,2
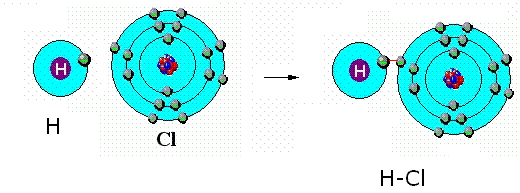
obr. Animovaná chemie - CD
nahoru
Vaznost je číslo, které udává, kolik kovalentních vazeb vytváří atom prvku v určité sloučenině.
Př. Vodík jednovazný, kyslík dvojvazný, dusík trojvazný
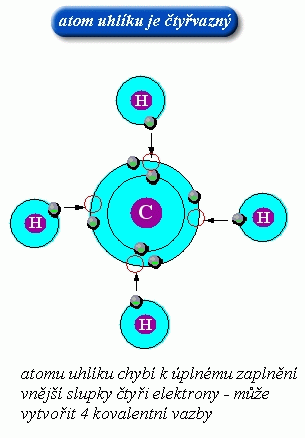
obr. Animovaná chemie - CD
Podle počtu elektronových párů mluvíme o kovalentní vazbě:
1. Jednoduché
obr. Animovaná chemie - CD
2. Dvojné
obr. Animovaná chemie - CD
3. Trojné
obr. Animovaná chemie - CD
nahoru
C) Kovová vazba - spočívá ve společném sdílením všech valenčních elektronů, které tvoří takzvaný elektronový plyn.

obr. Chemie I
Kationty mědi jsou ve svých polohách udržovány zápornými náboji volně pohyblivých valenčních elektronů.
Vytvořme si tuto představu: atomy kovů zbavíme valenčních elektronů a rozmístíme je do krystalové mřížky. Protože vzniklý útvar musí být elektroneutrální, odebrané valenční elektrony vrátíme mezi kationy kovů, kde se budou volně pohybovat jako kdybychom do této soustavy vypustili plyn (elektronový plyn).
Silná vazba, př. Ag, Al, Fe
D)Slabé vazebné interakcea) síly van der Waalsovy b) vazba vodíkovým můstkem