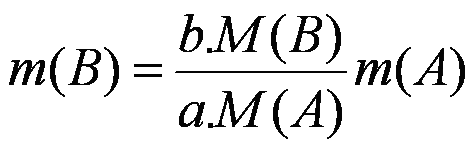INVESTICE DO ROZVOJE VZDĚLÁVÁNÍ
Výukové materiály ZŠ Kaplice, Školní 226





Význam chemických výpočtů:
při přípravě látek v chemických laboratořích při průmyslové chemické výrobě aby reakce proběhly beze zbytku a nedocházelo tak ke zbytečným ztrátám cenných chemikálií špatný nebo nepřesný výpočet může vest ke zdraví nebezpečnému stavu nebo výbuchu.
Příklad
Vypočítejte hmotnost sulfidu měďného, který vznikne reakcí mědi o hmotnosti 1,6 g se sírou.
I. Postup využitím logické úvahy a trojčlenky
Řešení: Samotný výpočet se skládá z těchto částí:
1. Zápis:
m (Cu) = 1,6g
m (Cu2S) = ? g
2. Chemickou reakci vyjádříme chemickou rovnicí.
2Cu + S ---> Cu2S
3. Podtrhneme v chemické rovnici reaktanty nebo produkty s nimiž se v příkladu počítá.
2Cu + S ---> Cu2S
4. Pod tyto látky zapíšeme jejich stechiometrické koeficienty a látková množství.
2Cu + S ---> Cu2S
2 mol Cu 1 mol Cu2S
5. Vypočítáme molární hmotnost těchto látek.
M(Cu) = 63,5 g/mol
M(Cu2S) = 159 g/mol
6. Vypočítáme hmotnost obou látek (m = n ·M)
m(Cu)= 2 mol x 63,5 g/mol = 127g
m(Cu2S)= 1 mol x 159 g/mol = 159g
7. Na základě úvahy použijeme k vypočtu trojčlenku.
Úvaha: Ze 127g mědi vznikne 159g sulfidu měďného. Kolik g sulfidu měďného vznikne z 1,6 g mědi?
127g Cu……………………159g Cu2S
1,6 g Cu……………………x Cu2S
x = 2 g
8. Napíšeme odpověď.
Reakcí 1,6 g mědi se sírou vzniknou 2 g sulfidu měďného.
II. Postup využitím obecného vztahu
2Cu + S ---> Cu2S
a A b B
m(A) m(B)
Hmotnost chemické látky B vypočteme dosazením do vztahu:
a, b jsou stechiometrické koeficienty
a = 2, b = 1
M(A) = M (Cu) = 63,5 g/mol
m(A) = m (Cu) = 1,6 g
M(B) = M (Cu2S) = 159 g/mol
m(B) = m (Cu2S) = ? g
Po dosažení do vztahu a vypočítaní m(B) = 2 g (Cu2S)