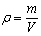INVESTICE DO ROZVOJE VZDĚLÁVÁNÍ
Výukové materiály ZŠ Kaplice, Školní 226





Látkové množství
Množství látky v kapce vody můžeme vyjádřit její hmotností, objemem nebo jako počet molekul:
m = 0,03 g V = 0,03 cm3 počet částic = 1021 molekul
obr. autor
Počet částic (atomů, molekul, iontů) v soustavě vyjadřuje veličina nazývaná látkové množství. Značí se písmenem n.
Jednotkou látkového množství je mol (značka také mol).
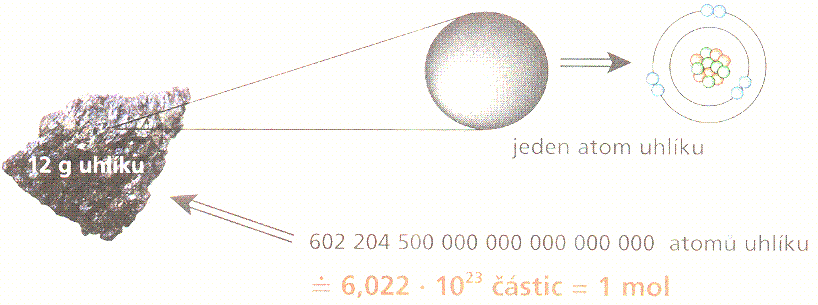
Jeden mol představuje takové látkové množství částic, kolik jich obsahuje 12 g uhliku.
obr. Animovaná chemie - CD
Jeden mol chemické látky je přibližně: 602 200 000 000 000 000 000 000 částic chemické látky (atomů, molekul, iontů).
1 mol = 6,022 · 1023 částic (atomů, molekul, iontů)
Př.
1 mol kyseliny sírové = 6,022 · 1023 molekul kyseliny sírové
1 mol zlata = 6,022 · 1023 atomů zlata
1 mol sulfidových aniontů = 6,022 · 1023 sulfidových aniontů
1 mol vodíkových kationtů = 6,022 · 1023 vodíkových kationtů
NA = 6,022 · 1023 částic (atomů, molekul, iontů) pro 1 mol.
NA - Avogadrova konstanta. Je to počet částic připadající na 1 mol látky.
Látkové množství n lze vypočitat, když počet částic N dělíme Avogadrovou konstantou: n = N/NA
nahoru
Látkové množství vyjadřují i chemické značky, vzorce a rovnice.
a) Význam chemických značek
N znamená: látka dusík, jeden atom dusíku, jeden mol atomů dusíku. 2 Cl znamená: látka chlor, dva atomy chloru, dva moly atomů chloru.
b) Význam chemických vzorců
N2 znamená: látka dusík, jedna molekula dusíku, jeden mol molekul dusíku. SO2 znamená: látka oxid siřičitý, jedna molekula oxidu siřičitého, jeden mol molekul oxidu siřičitého.
c) Význam chemických rovnic
Reakce 2Cu + O2 ----> 2CuO
vyjadřuje, že:
- měď reaguje s kyslíkem a vzniká oxid měďnatý, - reakcí dvou atomů mědi s 1 molekulou kyslíku vznikají 2 molekuly oxidu měďnatého, - reakcí 2 mol mědi a 1 mol kyslíku vznikají 2 mol oxidu měďnatého, - poměr látkových množství výchozích látek a produktu je 2:1:2
nahoru
Molární hmotnost
Př. Hmotnost atomu vodíku je přibližně 1,67.10-27 kg
Je to malá hodnota, proto je vhodné při výpočtech používat jednotky vztahující se k látkovému množství. Kolikrát bude větší počet částic, a tím i látkové množství určité chemické látky, tolikrát bude větší i hmotnost této chemické látky. Z toho tedy plyne, že podíl hmotnosti chemické látky a jejího látkového množství je pro každou chemickou látku stejný, konstantní.
Molární hmotnost M - je hmotnost všech cástic v jednom molu látky.
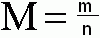
Jednotkou molární hmotnosti je kg/mol. Většinou však používáme menší jednotku g/mol.
Hodnoty molárních hmotností atomů prvků jsou uvedeny v tabulkách.
Molární hmotnost sloučeniny (molekuly) = součet molárních hmotností všech atomů, které vyjadřuje vzorec sloučeniny (molekuly).
1. Příklad
Vypočtěte molární hmotnost chloridu železitého (FeCl3)
M(FeCl3) = M(Fe) + 3xM(Cl) = 55,8 g/mol + 3x35,5 g/mol = 162,3 g/mol
2. Příklad
Vypočtěte molární hmotnost dihydrátu síranu vápenatého CaSO4.2H2O.
M(CaSO4.2H2O) = M(Ca) + M(S) +4xM(O) +4xM(H) + 2xM(O) = 40,08 g/mol + 32,06 g/mol + 4x 16 g/mol + 4x1,01g/mol + 2x 16g/mol = 172,18 g/mol
3. Příklad
Kolik mol je 317,25 g jodu?
M(I) = 126,9 g/mol
n = m/M = 317,25g/126,9 g/mol = 2,5 mol.
4. Příklad
Kolik mol je 10,8 g vody?
M(H2O) = 18 g/mol
n = m/M = 10,8g/18 g/mol = 0,6 mol.
nahoru
Molární objem Vm
Experimentálně se zjistilo, že 1 mol plynné látky zaujímá za normálních podmínek (t= 0 °C, p = 101 kPa) 22,4 l (dm3)
Vm = 22,4 l/mol
n - látkové množství (mol)
V - objem plynu (l)
Vm - molární objem plynu (l/mol)
látka (vzorec), n = 1 mol M (g/mol) Vm (l/mol) n (počet částic) Vodík (H2) 2,02 22,4 6,022 · 1023 molekul Chlor (Cl2) 70,9 22,4 6,022 · 1023 molekul Oxid uhelnatý (CO) 28 22,4 6,022 · 1023 molekul Amoniak (NH3) 17,04 22,4 6,022 · 1023 molekul
nahoru
Molární koncentrace c
Molární koncentrace (látková koncentrace) je veličina, která vyjadřuje obsah složek ve směsích přesněji než hmotnostní zlomek.
Používá se v chemii, lékařství a v ekologii při výpočtu obsahu látek ve vodních roztocíh.
Molární koncentrace roztoku se vypočte pomocí vzorce:
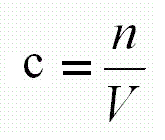
n - látkové množství (mol)
V - objem roztoku (l) (1l = 1 dm3)
c - molární koncentrace (mol/l nebo mol/dm3)
Hmotnostní zlomek w(s)
Hmotnostní zlomek w(s) rozpuštěné látky (s) v roztoku je podíl hmotnosti m(s) rozpuštěné látky (s) a hmotnosti m roztoku.
w(s) - hmotnostní zlomek látky (složky) rozpuštěné v roztoku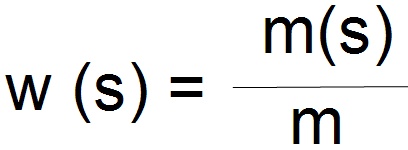
m(s) - hmotnost látky (složky) rozpuštěné v roztoku
m - hmotnost roztoku
nahoruHustota
Hustota r - je dána podílem hmotnosti m a objemu V těles z určité látky. Jednotkou hustoty je kg/m3, často se však používá g/cm3